* 모든 세균을 억제하는 특수 멸균 정수 필터 사용
* 은 나노 입자로 만든 임플란트 코팅은 적어도 동물 모델에서 이미 성공적
* 낮은 압력 가스에서 레이저 펄스로 생성되는 낮은 이온화 수준의 저온 플라즈마 사용
* Dispersin B는 특정 박테리아 생물막에서 발견되는 매트릭스 구성 요소 절단, 생물막 용해
* 인공적으로 생성된 "살균 박테리아"는 내성 세균과 생물막에 대해 매우 효과적
완고한 세균 집단에 대한 대책
생물막에서 박테리아의 생존 전략은 매우 효과적이다.
그럼에도 과학자들은 이미 생물막에 의한 감염이 발생한 경우 최초의 예방 조치 및 방제제를 개발할 수 있었고 새로운 가능성을 계속 연구하고 있다.
 |
▲ 세균 세포와 세포외 고분자 물질의 공간적으로 이질적인 배열을 자세히 보여주는 혼합 배양 생물막의 주사 전자 현미경 이미지. author: Krzysztof A. Zacharski |
한 가지 출발점은 의료 기기와 기구를 청소하는 것이다.
새로운 세균이 물과 함께 재료에 침투하지 않도록 특수 멤브레인의 도움으로 물에 결합된 모든 세균을 억제하는 특수 멸균 정수 필터가 사용된다.
접착 방지 코팅
또한, 미생물이 군집을 형성하고 생물막을 형성할 기회조차 주지 않는 임플란트, 카테터 등의 코팅에 대한 연구가 진행되고 있다. "박테리아와 싸우기 위해서는 부착 과정을 막아야 한다"라고 연방 물질 시험연구소(Federal Materials Testing and Research Institute)의 쿤 렌(Qun Ren)은 말한다.
튀빙겐 대학(University of Tübingen)의 프리드리히 괴츠(Friedrich Götz)가 이끄는 연구팀은 이 목적을 위해 코팅된 표면을 개발했다. 그 표면에서는 동물의 모피와 유사한 실과 같은 구조가 돌출되어 있다.
사실, 초기 시도에서 미생물은 스스로 부착하는 데 어려움을 겪었다. 그러나 연구자들이 신체의 자연 환경을 시뮬레이션하기 위해 모피 같은 표면을 혈액으로 덮었을 때 유기체가 면역 글로불린과 같은 혈액 성분에 결합할 수 있었기 때문에 박테리아 카펫이 다시 자랐다.
그러나 Götz와 그의 팀이 미리 박테리아를 면역 글로불린으로 처리하면 그들의 수용체가 점유되어 표면의 혈액 성분에 더 결합할 수 없었다.
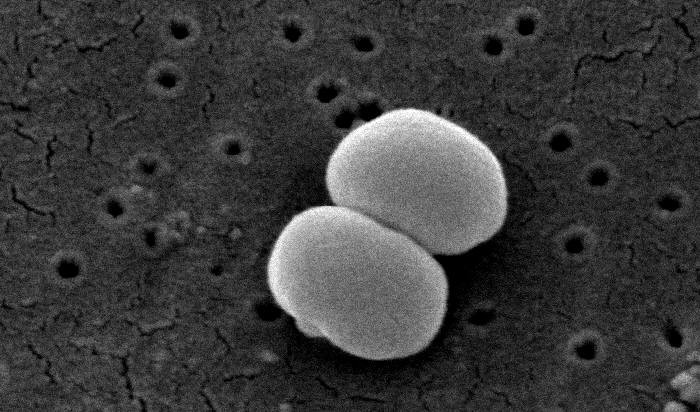 |
| ▲ Staphylococcus epidermidis의 주사 전자 현미경 사진 |
나노 은, 생물막을 억제한다.
은 나노 입자로 만든 임플란트 코팅은 적어도 동물 모델에서 이미 성공적이었다.
은은 살균 효과로 알려져 있으며 나노 입자 형태로 더 큰 표면 대 부피 비율로 인해 은 자체보다 더 잘 작동할 수 있다. 따라서 박테리아 Staphylococcus epidermidis에 의한 생물막 형성은 테스트에서 95%까지 감소될 수 있었다.
 |
▲ 서스펜션의 나노 은. (출처: https://nanoinitiative-bayern.de/nanosilber/ nanosilber/potenzial-von-nanosilber) |
라이프니츠 신소재 연구소(Leibniz Institute for New Materials)의 연구원들은 유사한 것을 발견했다. 은 및 구리 콜로이드를 사용한 항균, 내마모성 코팅이 장기간 안정적으로 세균을 죽이고 새로운 세균이 번식하는 것을 방지한다.
또 다른 연구팀은 아실라아제 효소와 폴리에틸렌이민 분자의 도움으로 의료용 카테터용 항균막 표면을 한 겹씩 도포한 실리콘 스트립을 테스트했다. 실제로, 박테리아의 부착은 최대 24시간 동안 효과적으로 억제될 수 있었다.
박테리아에 대한 바이러스
예를 들어 파지-박테리아를 공격하고 용해시키는 바이러스다. 그들은 숙주 특이성이 높기 때문에 특정 미생물에 대해 특이적으로 사용될 수 있고 또한 비활성 세포를 공격하여 반복 감염을 담당하는 지속성도 파괴된다.
문제점:
다중 감염 및 알려지지 않은 병원체의 경우, 파지의 숙주 특이성이 불리할 수 있다.
또한 박테리아가 파지에 대한 내성을 발달시키거나 파지가 제어할 박테리아에 내성 유전자를 전달할 수 있다. 이것이 유전 물질을 세균 게놈에 통합하지 않은 파지만이 치료에 사용될 수 있는 이유다.
기존 생물막을 파괴할 수 있는 또 다른 가능성이 우한의 후와즈홍 대학교(Huazhong University)의 신페이 루(Xinpei Lu)와 함께 일하는 연구원들에 의해 발견되었다.
그들은 낮은 압력의 가스에서 레이저 펄스에 의해 대부분 생성되는 낮은 이온화 수준의 저온 플라즈마를 사용했다. 이 플라즈마의 고에너지 전자가 주변 공기의 분자에 부딪히면 부분적으로 이온화되고 하이드록실 이온과 같은 반응성이 높은 새로운 화합물이 생성된다.
플라즈마는 입방 센티미터당 수십억 개의 자유 라디칼을 생성할 수 있다. 이것은 완고한 생물막에 있는 병원체조차도 현재의 방법으로는 거의 도움이 되지 않는 사멸될 수 있음을 의미한다.
매트릭스 파괴
또 다른 출발점은 생물막의 세포외 기질이다.
그것이 파괴되면 박테리아의 가장 중요한 보호 기능이 상실된다. 이에 대한 한 가지 가능성은 특수 효소를 사용하는 것이다.
Actinobacillus actinomycetemcomitans에서 파생된 Dispersin B는 특정 박테리아 생물막에서 발견되는 매트릭스 구성 요소를 절단하고 생체 내 및 시험관 내에서 생물막을 용해할 수 있는 효소다. 그러나 잠재적인 면역 반응으로 인해 효소의 생체 내 사용이 항상 가능한 것은 아니다.
생물막에서 박테리아를 함께 묶는 렉틴을 파괴하는 것도 효과적일 수 있다.
"렉틴은 생물막의 구성 요소를 네트워크로 연결한다"고 자르브뤼켄에 있는 Helmholtz Institute for Pharmaceutical Research의 알렉산더 티츠(Alexander Titz)가 설명했다.
일단 분리되면 생물막 거주자는 면역 체계나 항생제에 다시 취약해진다.
Titz는 그의 연구팀과 함께 위험한 세균 Pseudomonas aeruginosa의 생물막 형성을 억제하는 렉틴 차단 분자를 개발했다. 그리고 박테리아 간의 소통인 정족수 감지를 방해하는 활성 성분은 생물막의 안정성을 감소시킬 수 있다. 이를 위한 기금 마련을 위한 연구가 이미 진행되고 있다.
생물막 킬러로서의 박테리아
이미 유망한 이러한 방법 외에도 싱가포르 난양 공과대학의 장욱이 이끄는 연구원은 생물막에 대한 또 다른 특이한 전략을 개발했다. 즉, 치명적인 Pseudomonas aeruginosa 세균을 사냥하는 방식으로 무해한 장내 세균을 유전자 변형했다.
연구원들은 유전자 공학 방법을 사용하여 조작된 "도우미"의 센서와 무기를 처음부터 구성한 다음 운반체로 장내 세균에 이식했다. 실험실 테스트에서 이러한 인공적으로 생성된 "살균 박테리아"는 내성 세균과 생물막에 대해 매우 효과적인 것으로 입증되었다.
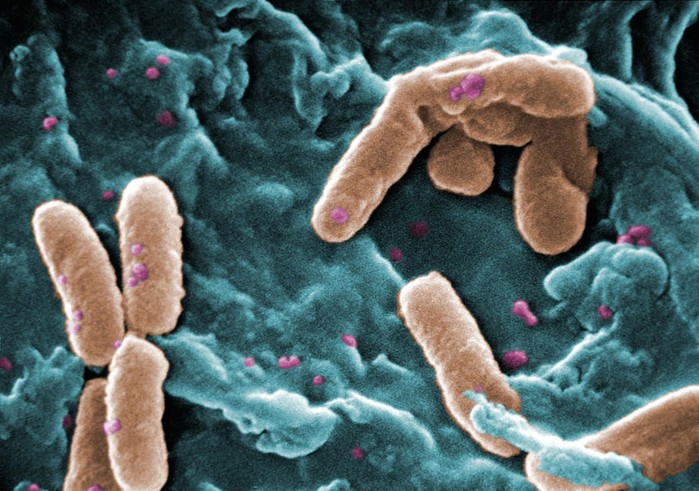 |
▲ Pseudomonas aeruginosa(녹농균綠膿菌),병원감염의 중요한 균종으로 심내막염, 폐렴, 수막염 등 여러 가지 사람의 질환의 원인이 된다 |
세균에 대한 가정 요법
생물막에 대항하는 또 다른 놀라운 무기는 중세 시대의 약이다.
Warwick 대학의 Jessica Furner-Pardoe와 동료들의 실험에 따르면 이 약은 황색포도상구균과 같은 병원성 박테리아를 효과적으로 죽이고 미생물 생물막에 대해 작용한다.
놀라운 점은 천년 된 안연고는 마늘, 양파, 포도주, 소담즙으로만 구성되어 있다.
이러한 성분은 개별적으로는 거의 효과가 없지만 함께 사용하면 예기치 않게 효과적이다.
그리고 또 다른 가정 요법이 감염 예방에 효과적이라고 한다. 다크 마누카 꿀은 항균력이 높을 뿐만 아니라 사우스햄프턴(Southampton) 대학의 바쉬르 엘왈리드(Bashir Lwaleed)와 그의 팀이 연구한 바에 따르면 생물막을 예방하는 데도 도움이 될 수 있었다. 매우 묽은 꿀 용액조차도 플라스틱에 대한 박테리아 필름의 접착력을 감소시키고 성장을 방해했다.
[더사이언스플러스=문광주 기자]
[저작권자ⓒ the SCIENCE plus. 무단전재-재배포 금지]
오늘의 이슈
주요기사
+
많이 본 기사
Basic Science
+
AI & Tech
+
Photos
+