(3분 읽기)
- 암은 세포가 통제되지 않은 방식으로 퇴화되고 증식할 때 발생
- 암세포에는 우리 몸의 46개 정상 세포보다 더 많은 염색체가 포함돼
- 많은 종양에는 세포 당 60~90개의 염색체, 일부 거대 암세포는 염색체 수의 8~16배
- 단백질 차단하면 암세포 죽는다.
암은 세포가 통제되지 않은 방식으로 퇴화되고 증식할 때 발생한다.
암의 유형과 감염된 조직에 따라 이러한 암세포의 유전적 특성은 매우 다를 수 있다.
일부는 DNA 복구의 빈번한 오류로, 다른 일부는 염색체의 폭발적인 손상으로 인해 발생한다. 이러한 개인차는 종양 질환을 효과적으로 퇴치하기 어렵게 만든다.
정상보다 더 많은 염색체
그러나 모든 암의 90% 이상이 공유하는 한 가지 특징이 있다.
암세포에는 우리 몸의 46개 정상 세포보다 더 많은 염색체가 포함돼 있다.
대신, 많은 종양에는 세포 당 60~90개의 염색체가 있으며, 일부 거대 암세포는 염색체 수의 8~16배까지 가질 수 있다. 이수성(염색체의 수가 기본수의 정수배보다 약간 증가하거나 감소하는 성질)으로 알려진 이러한 이상은 스핀들 장치가 세포 분열 중에 복사된 염색체를 서로 깔끔하게 분리하지 않기 때문에 발생한다.
이제 텔 아비브 대학의 야엘 코헨-샤리르(Yael Cohen-Sharir)와 함께 일하는 연구자들은 이러한 잘못된 분류에서 결정적인 역할을 하는 단백질을 발견했다.
그들은 인간 암 환자의 거의 1천 개의 세포주와 실험실에서 성장한 모델 암세포를 사용한 세포 분열 실험에서 이 행위자를 추적했다. 이수성 세포에서 어떤 특정 유전자와 분자가 활성인지 분석했다.
단백질을 차단하면 암세포가 죽는다.
결과 : 암세포에서 세포 분열의 특정 단계가 변경되었다.
소위 유사 분열 체크 포인트는 일반적으로 스핀들 장치가 자매 염색체를 올바르게 분리했는지 확인한 다음 세포 분열을 시작한다. 그러나 이수성 암세포의 경우 이 체크 포인트가 방해받는다. 염색체 번호가 정확하지 않으면 정상 세포는 빠르게 죽지만 계속해서 살아간다.
그 이유 중 하나는 Cohen-Sharir와 그의 동료들이 현재 발견한 단백질 KIF18A일 수 있다. KIF18A는 키네신 운동 단백질로 유사 분열 스핀들에 결합해 염색체 분리를 제어하는 데 도움이 되는 분자다. 이 단백질의 생산이 암세포에서 차단되면 과도한 염색체에도 불구하고 장기적으로 생존할 수있는 능력을 잃게 된다.
연구자들은 KIF18A가 정상 세포와 이수성 세포에서 어떻게 다른지 정확히 알지 못하지만, 분열하는 세포가 비정상적으로 많은 수의 염색체를 물리적으로 수용하는 데 도움이 된다고 의심한다. 이미징을 사용하여 이수성 세포의 유사 분열 스핀들이 정상 세포와 다른 모양을 가지고 있음을 확인할 수 있었다.
보다 광범위한 효과적인 암 치료를 위한 진입
과학자들에 따르면 KIF18A 단백질은 종양 퇴치를 위한 새로운 출발점을 제공 할 수 있다.
“현재 인간 세포에서 KIF18A를 차단하는 억제제는 없다. 그러나 메커니즘을 더 잘 이해하면 KIF18A 자체 또는 관련 프로세스를 공격하는 화학 분자를 개발할 수 있다”고 Kaiserslautern 기술 대학의 공동 저자 주자나 스토르초바(Zuzana Storchová)는 설명한다.
그러나 현재 관찰된 메커니즘이 인체의 종양에서도 동일한 방식으로 작동하는지 먼저 확인해야 한다. “우리의 결과는 모두 세포 배양을 기반으로 하므로 실제 인간 환자로 얼마나 잘 변환되는지 아직 알 수 없다”고 Tel-Aviv University의 선임 저자 우리 벤-다비드(Uri Ben-David)는 말한다. “그럼에도 불구하고 그들은 궁극적으로 암 환자의 치료에 영향을 미칠 가능성이 있는 유망한 연구 영역을 열어 놓았다.”
(Nature, 2021; doi : 10.1038 / s41586-020-03114-6)
출처 : Technical University of Kaiserslautern
- 암은 세포가 통제되지 않은 방식으로 퇴화되고 증식할 때 발생
- 암세포에는 우리 몸의 46개 정상 세포보다 더 많은 염색체가 포함돼
- 많은 종양에는 세포 당 60~90개의 염색체, 일부 거대 암세포는 염색체 수의 8~16배
- 단백질 차단하면 암세포 죽는다.
암세포에서 발견된 새로운 약점
단백질은 과도한 염색체가 있음에도 불구하고 종양 세포가 생존하도록 한다.
연구원들이 암세포에서 잠재적으로 보편적인 약점을 발견했다.
이것은 세포 분열 중에 염색체 분리에 중요한 역할을 하는 단백질이다.
분명히, 종양 세포는 과도한 염색체에도 불구하고 생존하기 위해 단백질을 필요로 한다.
그것의 봉쇄는 새로운 치료법의 출발점이 될 수 있다. 연구원들이 전문 저널 "Nature"에 보고한 내용이다.
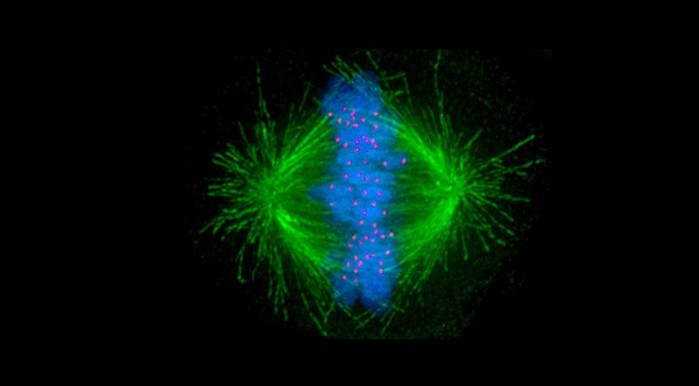 |
▲ 세포 분열 : 일반적으로 제어 메커니즘은 각 딸 세포가 정확한 수의 염색체를 받도록한다. 그러나 암세포의 경우 이 "체크 포인트"가 변경된다. © Afunguy / gemeinfrei |
암은 세포가 통제되지 않은 방식으로 퇴화되고 증식할 때 발생한다.
암의 유형과 감염된 조직에 따라 이러한 암세포의 유전적 특성은 매우 다를 수 있다.
일부는 DNA 복구의 빈번한 오류로, 다른 일부는 염색체의 폭발적인 손상으로 인해 발생한다. 이러한 개인차는 종양 질환을 효과적으로 퇴치하기 어렵게 만든다.
정상보다 더 많은 염색체
그러나 모든 암의 90% 이상이 공유하는 한 가지 특징이 있다.
암세포에는 우리 몸의 46개 정상 세포보다 더 많은 염색체가 포함돼 있다.
대신, 많은 종양에는 세포 당 60~90개의 염색체가 있으며, 일부 거대 암세포는 염색체 수의 8~16배까지 가질 수 있다. 이수성(염색체의 수가 기본수의 정수배보다 약간 증가하거나 감소하는 성질)으로 알려진 이러한 이상은 스핀들 장치가 세포 분열 중에 복사된 염색체를 서로 깔끔하게 분리하지 않기 때문에 발생한다.
이제 텔 아비브 대학의 야엘 코헨-샤리르(Yael Cohen-Sharir)와 함께 일하는 연구자들은 이러한 잘못된 분류에서 결정적인 역할을 하는 단백질을 발견했다.
그들은 인간 암 환자의 거의 1천 개의 세포주와 실험실에서 성장한 모델 암세포를 사용한 세포 분열 실험에서 이 행위자를 추적했다. 이수성 세포에서 어떤 특정 유전자와 분자가 활성인지 분석했다.
단백질을 차단하면 암세포가 죽는다.
결과 : 암세포에서 세포 분열의 특정 단계가 변경되었다.
소위 유사 분열 체크 포인트는 일반적으로 스핀들 장치가 자매 염색체를 올바르게 분리했는지 확인한 다음 세포 분열을 시작한다. 그러나 이수성 암세포의 경우 이 체크 포인트가 방해받는다. 염색체 번호가 정확하지 않으면 정상 세포는 빠르게 죽지만 계속해서 살아간다.
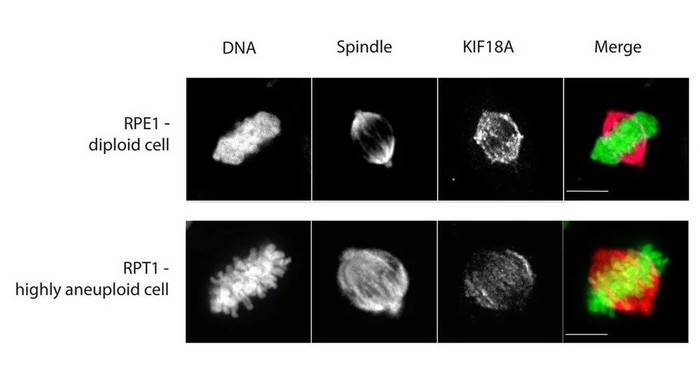 |
| ▲ 정상 세포 (위)와 이수성 암세포의 분열 비교. © Sara Bernhard / TU Kaiserslautern |
그 이유 중 하나는 Cohen-Sharir와 그의 동료들이 현재 발견한 단백질 KIF18A일 수 있다. KIF18A는 키네신 운동 단백질로 유사 분열 스핀들에 결합해 염색체 분리를 제어하는 데 도움이 되는 분자다. 이 단백질의 생산이 암세포에서 차단되면 과도한 염색체에도 불구하고 장기적으로 생존할 수있는 능력을 잃게 된다.
연구자들은 KIF18A가 정상 세포와 이수성 세포에서 어떻게 다른지 정확히 알지 못하지만, 분열하는 세포가 비정상적으로 많은 수의 염색체를 물리적으로 수용하는 데 도움이 된다고 의심한다. 이미징을 사용하여 이수성 세포의 유사 분열 스핀들이 정상 세포와 다른 모양을 가지고 있음을 확인할 수 있었다.
보다 광범위한 효과적인 암 치료를 위한 진입
과학자들에 따르면 KIF18A 단백질은 종양 퇴치를 위한 새로운 출발점을 제공 할 수 있다.
“현재 인간 세포에서 KIF18A를 차단하는 억제제는 없다. 그러나 메커니즘을 더 잘 이해하면 KIF18A 자체 또는 관련 프로세스를 공격하는 화학 분자를 개발할 수 있다”고 Kaiserslautern 기술 대학의 공동 저자 주자나 스토르초바(Zuzana Storchová)는 설명한다.
그러나 현재 관찰된 메커니즘이 인체의 종양에서도 동일한 방식으로 작동하는지 먼저 확인해야 한다. “우리의 결과는 모두 세포 배양을 기반으로 하므로 실제 인간 환자로 얼마나 잘 변환되는지 아직 알 수 없다”고 Tel-Aviv University의 선임 저자 우리 벤-다비드(Uri Ben-David)는 말한다. “그럼에도 불구하고 그들은 궁극적으로 암 환자의 치료에 영향을 미칠 가능성이 있는 유망한 연구 영역을 열어 놓았다.”
(Nature, 2021; doi : 10.1038 / s41586-020-03114-6)
출처 : Technical University of Kaiserslautern
[더사이언스플러스=문광주 기자] "no science, no future"
[저작권자ⓒ the SCIENCE plus. 무단전재-재배포 금지]
오늘의 이슈
뉴스댓글 >
주요기사
+
많이 본 기사
Basic Science
+
AI & Tech
+
Photos
+