3'30" 읽기
- 짧은 접촉만 감염 많고 잠복기 시간이 더 짧고 감염 직후 바이러스 부하가 최대 1천 배
- 막 융합에는 많은 에너지와 촉매 필요,델타 변종은 모든 변종보다 촉매 작용 더 잘 달성
- 목과 코의 ACE2 밀도가 낮더라도 병원체가 거기에 발판을 마련
- 바이러스의 결합 부위 델타 변이체에서 거의 변하지 않아 항체와 백신이 여전히 효과적
코로나바이러스는 숙주, 즉 우리 세포에 계속 적응한다.
이것은 현재 우리와 거의 모든 곳에서 SARS-CoV-2의 지배적인 형태가 된 델타 변종에 의해 입증되고 있다. 이 돌연변이 형태의 바이러스가 이전 형태보다 더 전염성이 강하고 예방 접종을 받은 사람들을 자주 감염시킬 수 있다는 것은 초기에 분명했다. 일부 증거에 따르면 델타 변이도 질병을 유발할 수 있지만 이것은 여전히 논쟁의 여지가 있다.
전염이 왜 그렇게 빠르고 효과적일까?
델타 변이가 이전보다 훨씬 더 전염성이 강한 이유는 무엇일까?
짧은 접촉만으로도 감염되는 경우가 많으며 잠복기 시간이 더 짧고 감염 직후 바이러스 부하가 최대 1천 배까지 높다. 보스턴에 있는 하버드 의과대학의 장 준(Jun Zhang)과 그의 동료들은 이제 이 숨겨진 바이러스 및 세포 특성을 더 자세히 조사했다.
Zhang의 동료 첸 빙(Bing Chen)은 "Delta가 그런 식으로 돌출되어 있기 때문에 다른 변형과 다르게 작동해야 한다고 생각했다"고 설명했다. 연구를 위해 그들은 인도에서 발전된 알파, 델타 및 카파 변이체를 포함한 다양한 코로나바이러스 변이체의 바이러스 스파이크 단백질에 인간 세포 배양물을 노출시켰다. 접근 방식에 따라 세포는 표면에 다른 밀도의 ACE2 수용체를 가지고 있었다. 이 수용체는 바이러스의 주요 도킹 사이트이다.
두 가지 최적화된 요소 확인
실험 결과:
델타 변이체가 나머지 변이체보다 훨씬 빠르고 효과적으로 세포를 감염시켰다.
한편으로 이것은 세포막과 융합하는 능력이 향상되었기 때문이다. 이는 세포를 관통하는 결정적인 단계다. "막 융합에는 많은 에너지와 촉매가 필요하다"고 Chen은 설명했다. "델타 변종은 다른 모든 변종보다 이 촉매 작용을 더 잘 달성했다."
특히 폭발 초기의 핵융합 속도는 Alpha와 동종의 핵융합 속도보다 거의 두 배나 높았다.
두 번째 이점도 있다.
높은 ACE2 밀도를 가진 세포 배양이 실험에 사용된 경우 감염률은 시간이 지남에 따라 거의 동일해졌다. 그러나 표적 세포가 표면에 ACE2 도킹 사이트가 몇 개만 있다면 달랐다. 그러면 델타 변이체가 다른 바이러스 유형보다 훨씬 더 효과적으로 세포를 감염시킬 수 있다.
"이는 Delta가 수용체 밀도가 낮은 세포에서도 막 융합을 최적화하도록 적응했음을 시사한다."고 팀이 설명했다.
과학자들에 따르면, 델타 변이체를 전염성 있게 만드는 것은 주로 이러한 두 가지 적응이다. Zhang과 그의 동료들은 "이 최적화는 델타 변이체가 비교적 짧은 접촉 후에도 전염될 수 있는 이유를 설명할 수 있다"고 말했다. 목과 코의 ACE2 밀도가 낮더라도 병원체가 거기에 발판을 마련하기 때문이다. 연구진은 "바이러스가 더 짧은 시간에 더 많은 세포를 감염시킬 수 있기 때문에 잠복기 시간이 단축되고 감염 후 바이러스 부하가 더 높아진다"고 말했다.
어떤 돌연변이가 이에 대한 책임이 있을까?
극저온 전자 현미경을 사용한 추가 분석이 보여주듯이 스파이크 단백질의 결합 부위에서의 돌연변이는 델타 변이체를 최적화하는 데 분명히 책임이 없다. 결합 지점에서 델타 변형은 이전 버전과 비교하여 두 곳만 변경되었다.
Zhang과 그의 팀은 "이러한 변화는 ACE2와 접촉하고 수용체 결합에 거의 영향을 미치지 않는 표면 때문이 아니다"고 말했다.
그러나 N-말단 도메인(NTD)의 구성에 더 중요한 변화가 있다.
스파이크 단백질의 이 부분은 바이러스가 세포에 부착될 때 접히는 데 중요하다. 단백질 구성이 뒤집어질 때만 세포막과의 융합이 일어나고 바이러스가 세포에 침투할 수 있다. 분석에서 밝혀진 바와 같이 Delta의 N-말단 도메인에는 여러 단백질 루프의 모양을 변경하는 3개의 점 돌연변이와 2개의 누락된 아미노산이 있다. 그것은 델타 변이체가 우리 세포와 더 잘 융합할 수 있는 이유를 설명할 수 있다.
결국 이 모든 것에도 긍정적인 측면이 있다.
코로나바이러스의 결합 부위가 델타 변이체에서 거의 변하지 않았기 때문에 대부분의 항체와 백신이 여전히 효과적이다. 이것은 미래에도 적용될 수 있다. "바이러스가 빠르게 돌연변이를 일으켜 구조를 변경할 수 있기 때문에 N-말단 도메인을 목표로 해서는 안된다"고 Chen은 설명했다. 덜 가변적인 결합 부위에서 보호 및 대응책으로 시작하는 것이 훨씬 더 효과적이다. (Science, 2021; doi: 10.1126 / science.abl9463)
출처: Boston Children’s Hospital
- 짧은 접촉만 감염 많고 잠복기 시간이 더 짧고 감염 직후 바이러스 부하가 최대 1천 배
- 막 융합에는 많은 에너지와 촉매 필요,델타 변종은 모든 변종보다 촉매 작용 더 잘 달성
- 목과 코의 ACE2 밀도가 낮더라도 병원체가 거기에 발판을 마련
- 바이러스의 결합 부위 델타 변이체에서 거의 변하지 않아 항체와 백신이 여전히 효과적
코로나: 델타 변이체가 전염성이 강한 이유
돌연변이를 통해 도킹 사이트가 거의 없는 경우에도 바이러스가 세포에 빠르게 침투할 수 있다.
최적화된 구성:
연구원들이 SARS-CoV-2의 델타 변종이 이전 버전보다 더 전염성이 강한 이유를 알아냈다. 이들의 돌연변이는 이 코로나바이러스가 다른 변이체보다 빠르게 세포에 도킹하고 침투할 수 있도록 스파이크 단백질의 구성을 변경한다. 또 다른 차이점은 델타 변이체는 ACE2 수용체가 적은 세포에서 이점이 있으므로 더 효과적으로 공격할 수 있다.
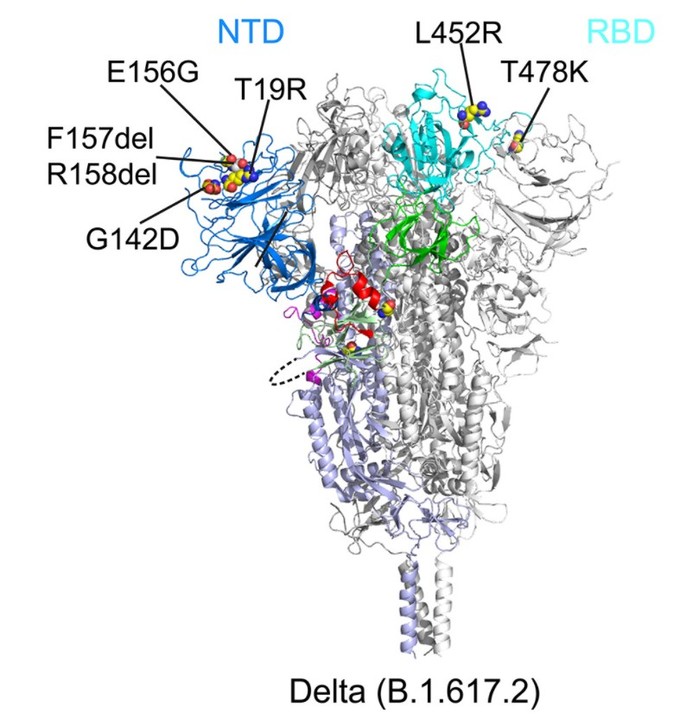 |
| ▲ 델타 변이체에서 스파이크 단백질의 N-말단 도메인(NTD) 및 결합 부위(RBD)의 변화. © Bing Chen / 보스턴 어린이 병원 |
코로나바이러스는 숙주, 즉 우리 세포에 계속 적응한다.
이것은 현재 우리와 거의 모든 곳에서 SARS-CoV-2의 지배적인 형태가 된 델타 변종에 의해 입증되고 있다. 이 돌연변이 형태의 바이러스가 이전 형태보다 더 전염성이 강하고 예방 접종을 받은 사람들을 자주 감염시킬 수 있다는 것은 초기에 분명했다. 일부 증거에 따르면 델타 변이도 질병을 유발할 수 있지만 이것은 여전히 논쟁의 여지가 있다.
전염이 왜 그렇게 빠르고 효과적일까?
델타 변이가 이전보다 훨씬 더 전염성이 강한 이유는 무엇일까?
짧은 접촉만으로도 감염되는 경우가 많으며 잠복기 시간이 더 짧고 감염 직후 바이러스 부하가 최대 1천 배까지 높다. 보스턴에 있는 하버드 의과대학의 장 준(Jun Zhang)과 그의 동료들은 이제 이 숨겨진 바이러스 및 세포 특성을 더 자세히 조사했다.
Zhang의 동료 첸 빙(Bing Chen)은 "Delta가 그런 식으로 돌출되어 있기 때문에 다른 변형과 다르게 작동해야 한다고 생각했다"고 설명했다. 연구를 위해 그들은 인도에서 발전된 알파, 델타 및 카파 변이체를 포함한 다양한 코로나바이러스 변이체의 바이러스 스파이크 단백질에 인간 세포 배양물을 노출시켰다. 접근 방식에 따라 세포는 표면에 다른 밀도의 ACE2 수용체를 가지고 있었다. 이 수용체는 바이러스의 주요 도킹 사이트이다.
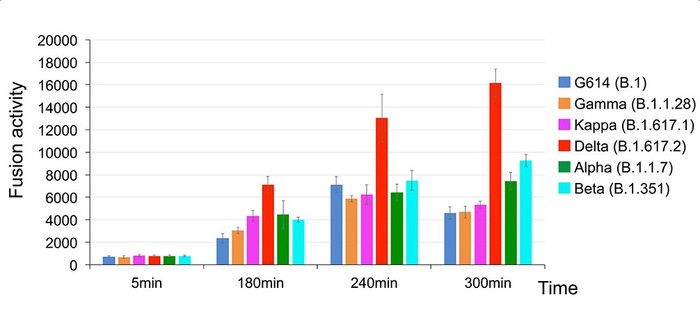 |
| ▲ 델타 변이는 다른 변이보다 세포막과 더 빠르고 효과적으로 융합된다. © Zhang J. et al./ Science 2021 |
두 가지 최적화된 요소 확인
실험 결과:
델타 변이체가 나머지 변이체보다 훨씬 빠르고 효과적으로 세포를 감염시켰다.
한편으로 이것은 세포막과 융합하는 능력이 향상되었기 때문이다. 이는 세포를 관통하는 결정적인 단계다. "막 융합에는 많은 에너지와 촉매가 필요하다"고 Chen은 설명했다. "델타 변종은 다른 모든 변종보다 이 촉매 작용을 더 잘 달성했다."
특히 폭발 초기의 핵융합 속도는 Alpha와 동종의 핵융합 속도보다 거의 두 배나 높았다.
두 번째 이점도 있다.
높은 ACE2 밀도를 가진 세포 배양이 실험에 사용된 경우 감염률은 시간이 지남에 따라 거의 동일해졌다. 그러나 표적 세포가 표면에 ACE2 도킹 사이트가 몇 개만 있다면 달랐다. 그러면 델타 변이체가 다른 바이러스 유형보다 훨씬 더 효과적으로 세포를 감염시킬 수 있다.
"이는 Delta가 수용체 밀도가 낮은 세포에서도 막 융합을 최적화하도록 적응했음을 시사한다."고 팀이 설명했다.
과학자들에 따르면, 델타 변이체를 전염성 있게 만드는 것은 주로 이러한 두 가지 적응이다. Zhang과 그의 동료들은 "이 최적화는 델타 변이체가 비교적 짧은 접촉 후에도 전염될 수 있는 이유를 설명할 수 있다"고 말했다. 목과 코의 ACE2 밀도가 낮더라도 병원체가 거기에 발판을 마련하기 때문이다. 연구진은 "바이러스가 더 짧은 시간에 더 많은 세포를 감염시킬 수 있기 때문에 잠복기 시간이 단축되고 감염 후 바이러스 부하가 더 높아진다"고 말했다.
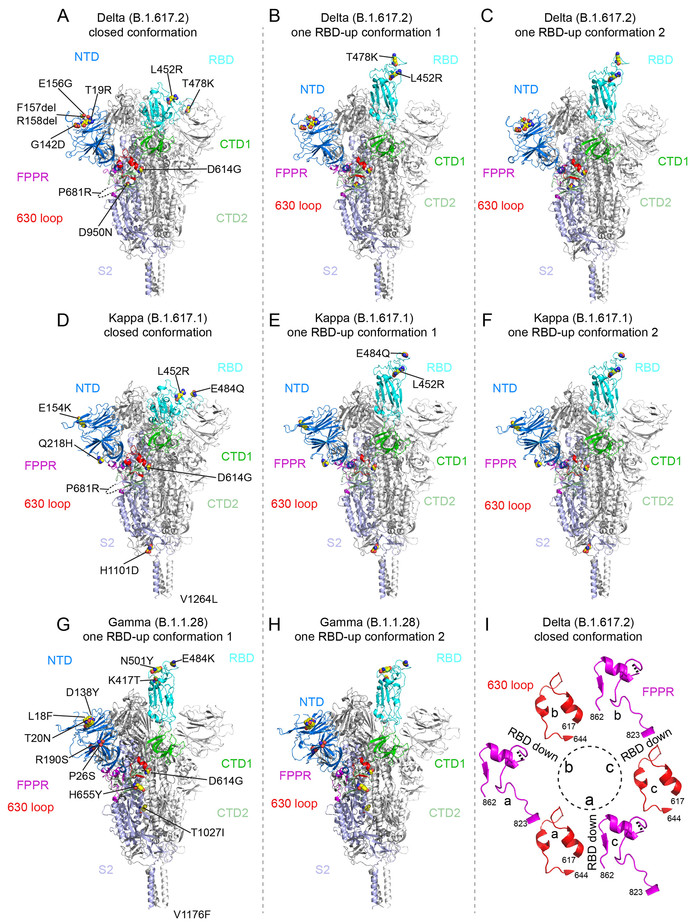 |
| ▲ 그림 3. Delta, Kappa 및 Gamma 변이체의 전장 SARS-CoV-2 S 단백질의 Cryo-EM 구조 (A~C) Delta S 삼량체는 파란색 NTD, 청록색 RBD, 녹색 CTD1, 연녹색 CTD2, 연청색 S2, 빨간색 630 루프, 마젠타색 FPPR로 표시된 하나의 프로토머가 있는 리본 다이어그램에 표시. (D에서 F) Kappa S 삼량체의 닫힌 prefusion 형태와 두 개의 one-RBD-up 형태의 구조는 (A)와 동일한 색 구성표를 사용하여 리본 다이어그램에 표시. (G) 및 (H) 감마 S 삼량체의 두 개의 1-RBD-업 구조의 구조는 (A)와 동일한 색 구성표를 사용하여 리본 다이어그램에 표시다. 세 가지 변이체의 모든 돌연변이는 원래 바이러스(D614)와 비교해 구형 모델에서 강조 표시. (I) 델타 폐쇄 삼량체의 구조, 630 루프(빨간색)를 포함하는 세그먼트(잔기 617-644) 및 3개의 프로토머(A) 각각의 FPPR(자홍색)을 포함하는 세그먼트(잔기 823-862), (B) 및 (C). 각 RBD의 위치가 표시된다. 점선은 체인 트레이스의 간격(무질서한 루프)을 나타낸다. (출처: 관련논문 Fig 3. Membrane fusion and immune evasion by the spike protein of SARS-CoV-2 Delta variant / Science) |
어떤 돌연변이가 이에 대한 책임이 있을까?
극저온 전자 현미경을 사용한 추가 분석이 보여주듯이 스파이크 단백질의 결합 부위에서의 돌연변이는 델타 변이체를 최적화하는 데 분명히 책임이 없다. 결합 지점에서 델타 변형은 이전 버전과 비교하여 두 곳만 변경되었다.
Zhang과 그의 팀은 "이러한 변화는 ACE2와 접촉하고 수용체 결합에 거의 영향을 미치지 않는 표면 때문이 아니다"고 말했다.
그러나 N-말단 도메인(NTD)의 구성에 더 중요한 변화가 있다.
스파이크 단백질의 이 부분은 바이러스가 세포에 부착될 때 접히는 데 중요하다. 단백질 구성이 뒤집어질 때만 세포막과의 융합이 일어나고 바이러스가 세포에 침투할 수 있다. 분석에서 밝혀진 바와 같이 Delta의 N-말단 도메인에는 여러 단백질 루프의 모양을 변경하는 3개의 점 돌연변이와 2개의 누락된 아미노산이 있다. 그것은 델타 변이체가 우리 세포와 더 잘 융합할 수 있는 이유를 설명할 수 있다.
결국 이 모든 것에도 긍정적인 측면이 있다.
코로나바이러스의 결합 부위가 델타 변이체에서 거의 변하지 않았기 때문에 대부분의 항체와 백신이 여전히 효과적이다. 이것은 미래에도 적용될 수 있다. "바이러스가 빠르게 돌연변이를 일으켜 구조를 변경할 수 있기 때문에 N-말단 도메인을 목표로 해서는 안된다"고 Chen은 설명했다. 덜 가변적인 결합 부위에서 보호 및 대응책으로 시작하는 것이 훨씬 더 효과적이다. (Science, 2021; doi: 10.1126 / science.abl9463)
출처: Boston Children’s Hospital
[더사이언스플러스=문광주 기자]
[저작권자ⓒ the SCIENCE plus. 무단전재-재배포 금지]
오늘의 이슈
뉴스댓글 >
주요기사
+
많이 본 기사
Basic Science
+
AI & Tech
+
Photos
+